Princípio de funcionamento da bateria
Como funcionam um relógio de parede, um controle remoto de TV ou um brinquedo infantil controlado por rádio? A maioria das pessoas, sem hesitação, responderá “com baterias” e, em princípio, terão razão. Mas é improvável que algum deles consiga dizer exatamente como a bateria portátil é triplicada, como funciona e sem a qual todo o processo de transmissão da corrente elétrica da bateria ao consumidor final seria impossível. Vamos preencher essa lacuna irritante de conhecimento.
O conteúdo do artigo
Princípio de funcionamento da bateria
Para entender o princípio de funcionamento de uma bateria AA convencional, é necessário ter um conhecimento geral de sua estrutura. Assim, qualquer bateria consiste em três elementos principais - ânodo, cátodo e eletrólito. Além disso, este último pode ter praticamente qualquer estado de agregação: o cátodo e o ânodo colocados numa solução salina, em princípio, também são uma “bateria”, apenas numa forma incomum para a pessoa média.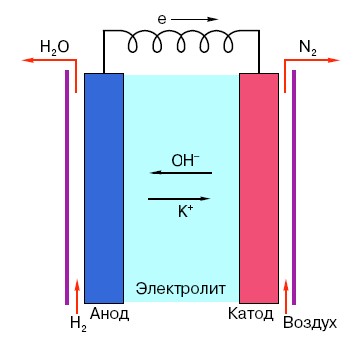
Interessante! A chamada “coluna voltaica”, inventada por Alessandro Volta, também possuía todos os elementos necessários para a produção de corrente elétrica. Consistia em placas de zinco e cobre empilhadas umas sobre as outras, entre as quais era colocado um pano embebido em ácido como “camada”.
O ânodo em tais sistemas é a principal fonte de elétrons, que, como sabemos no curso escolar de física, têm carga negativa.Partículas carregadas negativamente são atraídas pelas positivas e, neste caso, a superfície do cátodo atua como um “mais”.
Mas isso não é suficiente para que ocorra uma corrente elétrica, porque os elétrons também precisam de uma espécie de “rodovia” - um meio que suportaria a interação do cátodo e do ânodo. É aqui que um eletrólito aparece “no palco” - um sal, álcali ou ácido capaz de conduzir corrente.
Vejamos o princípio de funcionamento usando um exemplo específico: existe uma bateria de 18 volts. A tensão entre os eletrodos permanece estável até que seja conectado à rede. Assim que aparece um consumidor (por exemplo, uma lâmpada comum), a tensão começa a diminuir gradativamente, a corrente começa a fluir do eletrodo “negativo” para o “positivo” e ocorre uma reação química no eletrólito visando mantendo a diferença de potencial entre os eletrodos.
Referência. Quanto mais energia o consumidor necessitar, mais intensa será a reação dentro da bateria e mais rapidamente ela irá falhar.
Como funciona uma bateria recarregável, como ela difere de uma bateria normal
Então, olhamos para as clássicas baterias de “dedo” e “dedo mínimo” e sabemos que a vida útil da maioria delas é estritamente limitada (não importa o que digam os fabricantes famosos). Mas e as chamadas baterias - baterias do tipo bateria que podem não apenas consumir energia durante o processo de reação, mas também acumulá-la e armazená-la por muito tempo?
Para entender o princípio de funcionamento da bateria, é necessário recorrer à química. Tomemos como exemplo... Um fogo normal de carvão.Não importa quão bela e fascinante a chama pareça, qualquer químico que a observe sabe que esse processo é apenas uma reação de oxidação de combustível de longo prazo. A queima do carvão interage com o oxigênio e como resultado desta reação obtemos:
- dióxido de carbono;
- luz;
- esquentar.
E se os dois últimos pontos são capazes de aquecer a alma e o corpo, então não podemos utilizar de forma alguma o dióxido de carbono, porque é um subproduto da reação, que é, na verdade, seu desperdício. A reação de oxidação para quando os elementos iniciais: oxigênio e carvão acabam. A interrupção da reação em uma bateria ocorre exatamente da mesma maneira quando as substâncias iniciais estão completamente esgotadas e apenas restam “resíduos”.
Na bateria tudo acontece um pouco diferente. O fato é que a reação que nele ocorre pertence à categoria de reversível, ou seja, sob certas condições pode ser “revertida”, devolvendo todas as substâncias ao seu estado original. É a possibilidade de ocorrer uma reação reversível na bateria que permite que ela seja carregada.
Em uma bateria conectada à rede, a reação ocorre na direção oposta e a corrente flui de “mais” para “menos”, e não vice-versa. Como resultado, o produto da reação forma as substâncias iniciais e o proprietário da bateria recebe a energia “recuperada” disponível em formato portátil. Isso é tudo!





